Anvisa acelera acesso a vacinas e medicamentos contra varíola dos macacos
O diretor da Anvisa afirmou que um dos papéis da instituição é proteger a saúde da população e promover o acesso a insumos e medicamentos
• Atualizado
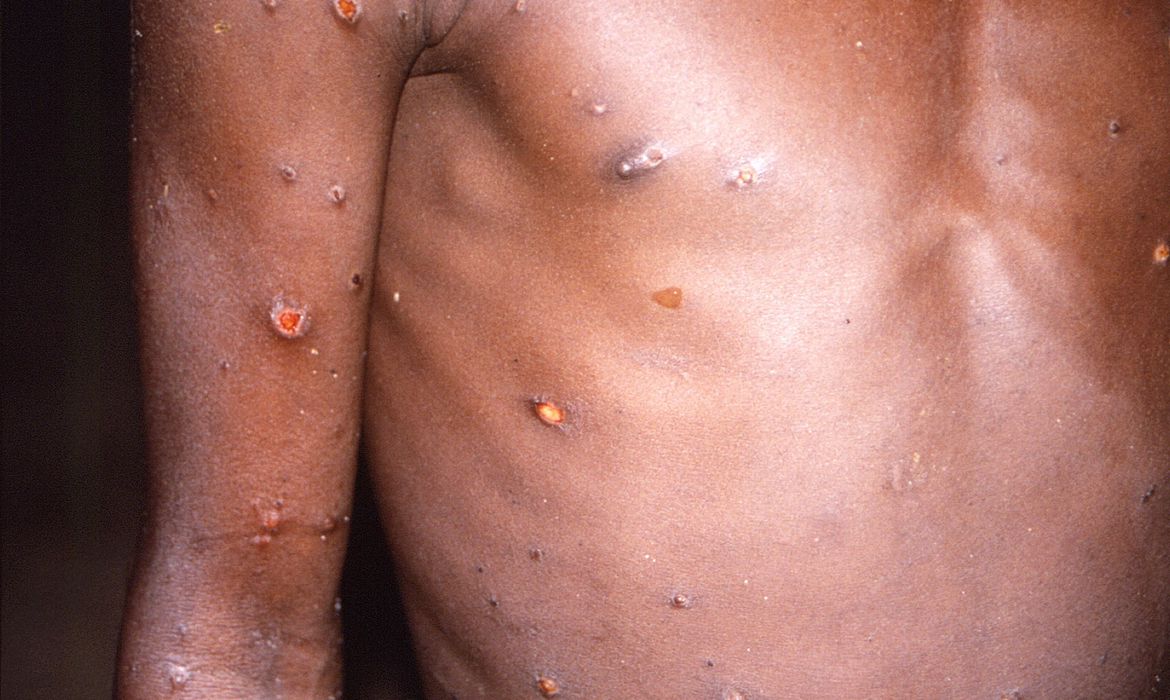
A Anvisa (Agência Nacional de Vigilância Sanitária) aprovou, nesta sexta-feira (19) a norma que prevê a dispensa de registro para importação de medicamentos e vacinas utilizado na prevenção ou tratamento da varíola dos macacos – monkeypox.
A diretoria colegiada da Anvisa explicou que “a norma, de caráter excepcional e temporário, permite que o ministério da Saúde solicite à Agência a dispensa de registro de medicamentos e vacinas que já tenham sido aprovados para prevenção ou tratamento da monkeypox por autoridades internacionais especificadas na respectiva resolução”.
O diretor da Anvisa, Daniel Pereira, afirmou que um dos papéis da instituição é proteger a saúde da população e promover o acesso a insumos e medicamentos. E reforçou que, hoje, a Anvisa “não está aprovando vacinas ou medicamentos. A presente proposta em discussão visa compatibilizar, dando segurança jurídica e, ao mesmo tempo, o necessário cumprimento do regulamento sanitário”.
O diretor-presidente, Antonio Barra Torres, reforçou dizendo que “é importante deixar claro que a Anvisa está exercendo seu papel de agência reguladora. A dispensa de registro é um ato regulatório. E esse ato não significa a aprovação tácita do que vier. Diante de mais um desafio, estamos utilizando uma ferramenta que faz parte do exercício pleno de nossa função”, defendeu.
Na prática
A Anvisa esclareceu que “a norma prevê um rito simplificado semelhante ao modelo já adotado para as importações por meio do Covax Facility, a aliança internacional formada para acelerar o desenvolvimento, a produção e a distribuição de vacinas contra Covid-19. O pedido de dispensa de registro será avaliado com prioridade pelas áreas técnicas da Anvisa e a decisão deverá ocorrer em até sete dias úteis”.
E ainda: “o medicamento ou vacina deve ter todos os locais de fabricação, incluindo linhas e formas farmacêuticas, aprovados por autoridades reguladoras integrantes do Esquema de Cooperação em Inspeção Farmacêutica (PIC/S)”.
Por fim, a Agência Nacional de Vigilância Sanitária listou as referências que serão consideradas as aprovações de medicamentos ou vacinas emitidas pelas seguintes autoridades internacionais:
- Organização Mundial da Saúde (OMS)
- Agência Europeia de Medicamentos (EMA)
- Administração de Alimentos e Medicamentos dos Estados Unidos (FDA/EUA)
- Agência Reguladora de Medicamentos e Produtos de Saúde do Reino Unido (MHRA/UK)
- Agência de Produtos Farmacêuticos e Equipamentos Médicos/Ministério da Saúde, Trabalho e Bem-Estar do Japão (PMDA/MHLW/JP)
- Agência Reguladora do Canadá (Health Canada)
>> SIGA O SCC10 NO TWITTER, INSTAGRAM E FACEBOOK.
Quer receber notícias no seu whatsapp?
EU QUERO

